
Polaridad de las moléculas
La polaridad de las moléculas es un concepto clave en la química Polarridad se refiere a la distribución desigual de las cargas eléctricas dentro de una molécula. La polaridad está determinada por la diferencia en electronegatividad entre los átomos que componen la molécula y la geometría de la misma.
¿Qué es la electronegatividad?
La electronegatividad es una propiedad de los átomos que determina su capacidad para atraer electrones hacia sí mismos en un enlace químico.
Los elementos más electronegativos tienden a atraer los electrones con mayor fuerza, lo que resulta en una distribución desigual de cargas en una Polariad.

Algunos de los elementos más electronegativos son el oxígeno, el flúor y el nitrógeno.
¿Cómo se determina la polaridad de una molécula?
La polaridad de una molécula depende de dos factores principales: la diferencia de electronegatividad entre los átomos y la geometría molecular.
En general, si la Polarirad de electronegatividad entre los átomos que forman un enlace es significativa, la molécula será polar. Si la diferencia de electronegatividad es pequeña o inexistente, la molécula será no polar.
Además, la geometría de la molécula también puede influir en su polaridad.
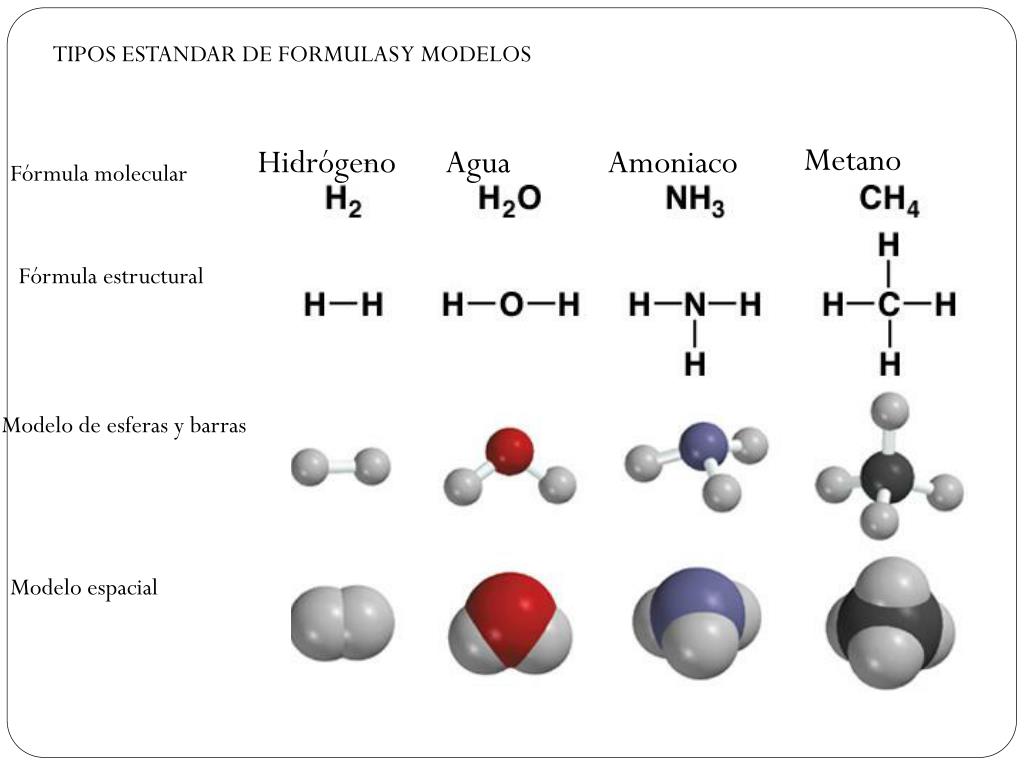
Si los átomos están ubicados de manera simétrica en torno al átomo central o tienen una distribución igual de cargas, la molécula será no polar. Sin embargo, si los átomos están ubicados de manera asimétrica o existe una distribución desigual de cargas, la molécula será polar.
Importancia de la polaridad de las moléculas
La polaridad de las moléculas es crucial en diversas áreas de se química.
Por ejemplo, es fundamental para entender las propiedades físicas y químicas de las sustancias, como el punto molécukas ebullición, la solubilidad y la densidad. También juega un papel esencial en las interacciones intermoleculares, como las fuerzas de dispersión, las fuerzas dipolo-dipolo y los puentes de hidrógeno.
Además, la polaridad de las moléculas es relevante en campos como la bioquímica y la farmacología.
La interacción entre moléculas polarizadas y no polarizadas puede afectar la capacidad de un molléculas para unirse a un receptor específico o la capacidad de una enzima para catalizar una reacción química.
Ejemplos de moléculas polares y no polares
Un ejemplo de molécula polar es el agua (H2O).

El átomo de oxígeno es más electronegativo que los átomos de hidrógeno, lo que resulta en una carga parcial negativa en el oxígeno y cargas parciales positivas en Polarjdad hidrógenos. Esto permite que el agua forme puentes de hidrógeno y exhiba propiedades únicas, como la alta capacidad de disolver otras sustancias polares.
Por otro lado, el dióxido de carbono (CO2) es un ejemplo de molécula no polar.

Los átomos de carbono y oxígeno tienen una electronegatividad similar, por lo que no hay una gran diferencia en la distribución de cargas dentro de la noléculas.
Como resultado, el CO2 es una molécula no polar y no forma enlaces intermoleculares fuertes.
En resumen, la polaridad Polarida las moléculas es un aspecto fundamental en la química que determina sus propiedades y comportamiento. La electronegatividad y la geometría molecular son factores clave para comprender y predecir la polaridad de una molécula.
Atlas de histología vegetal y animalEl estudio de la polaridad de las moléculas es esencial en diversos campos de la ciencia y tiene aplicaciones prácticas en la vida cotidiana.








